Class 10 science Chapter 2 अम्ल क्षारक एवं लवण Notes in hindi
प्रिय विद्यार्थियों आप सभी का स्वागत है आज हम आपको Class 10 Science Notes PDF in Hindi Chapter 2 Acids Bases and Salts Notes PDF in Hindi कक्षा 10 विज्ञान नोट्स हिंदी में उपलब्ध करा रहे हैं |Class 10 Vigyan Ke Notes PDF
यहां पर आपको क्लास 10 विज्ञान Chapter 2 अम्ल क्षारक एवं लवण Notes in hindi नोट्स मिलेंगे जिसे आप पढ़ कर बोर्ड एग्जाम अच्छे नंबर आ सकते है .
Chapter 2 Aml kshaarak evam Lavaṇ
Class 10 Science Chapter 2 Acids Bases and Salts Notes PDF in Hindi
| Textbook | NCERT |
| Class | Class 10 |
| Subject | विज्ञान |
| Chapter | Chapter 2 |
| Chapter Name | अम्ल क्षारक एवं लवण |
| Category | Class 10 Science Notes |
| Medium | Hindi |
अध्याय एक नजर में Class 10 Science Chapter 2 PDF Notes
पाठ-2 अम्ल, क्षारक एवं लवण
- अम्ल: (ACID)
- ये स्वाद में खट्टे होते हैं।
- ये नीले लिटमस को लाल में बदल देते हैं।
- उदाहरण-
हाइड्रोक्लोरिक अम्ल HCl
सल्फयूरिक अम्ल H2SO4
नाइट्रिक अम्ल HNO3
एसिटिक अम्ल CH3COOH
- क्षार : (Base)
- ये स्वाद में कड़वे होते हैं।
- ये लाल लिटमस को नीले में बदल देते हैं।
- उदाहरण-
सोडियम हाइड्रोक्लोरिक NaOH
पोटेशियम हाइड्रोक्साइड KOH
कैल्सियम हाइड्रोक्साइड Ca(OH)2
अमोनियम हाइड्रोक्साइड NH4OH
- कुछ प्राकृतिक अम्ल
सिरका – एसिटिक अम्ल
संतरा, नींबू – सिट्रिक अम्ल
टमाटर – आक्जैलिक अम्ल
इमली – ट्रारटरिक अम्ल
दही – लैक्टिक अम्ल
चींटी और नेटल का डंक – मिथोनोइक अम्ल
- अम्ल-क्षार सूचक– सूचक किसी दिए गए विलयन में अम्ल या क्षार की उपस्थिति दर्शाते हैं।
- लिटमस विलयन- यह एक प्राकृतिक सूचक है। यह लाइकेन से प्राप्त होने वाली नीले रंग की डाई है। सूचकों के अन्य उदाहरण हैं लाल पत्ता गोभी, पेटिनया फूल की रंगीन पंखुड़ियां एवं हल्दी।
- गंधीय सूचक– ऐसे पदार्थ जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है। उदाहरण प्याज और लौंग।
| अम्ल-क्षार सूचक | |||
| क्रम सं. | सूचक का नाम | अम्ल के साथ रंग में परिवर्तन | क्षार के साथ रंग में परिवर्तन |
(क) | नीला लिटमस विलयन | लाल रंग में परिवर्तन | रंग परिवर्तन नहीं होता |
(ख) | लाल लिटमस विलयन | कोई परिवर्तन नहीं | नीले रंग में बदल जाता है |
(ग) | हल्दी | कोई परिवर्तन नहीं | लाल रंग में बदल जाता है |
(घ) | मिथाइल ओरेंज | लाल रंग में बदल जाता है | पीले रंग में बदल जाता है |
(ङ) | फिनोफ्थलीन (रंगहीन) | कोई परिवर्तन नहीं | गुलाबी रंग में बदल जाता है |
आप पढ़ रहे है : अम्ल, क्षार एवं लवण : Science class 10th:Hindi Medium
- तनु अम्ल– जिसमें अल्प मात्रा में अम्ल तथा अधिक मात्रा में जल होता हैं।
- सान्द्र अम्ल– सान्द्र अम्ल में अम्ल अधिक मात्रा में होता है जबकि जल अल्प मात्रा में होता है।
- अम्ल व क्षारों के रासायिनक गुण
अम्ल + धातु → लवण + हाइड्रोजन
2HCl + Zn → ZnCI2 + H2
2HNO3 + Zn → Zn(NO3)2 + H2
H2SO4 + Zn → ZnSO4 + H2
2CH3COOH + Zn → (CH3COO)2Zn + H2 - पॉप टैस्ट– हाइड्रोजन गैस से निहित परखनली के पास जब एक जलती हुई मोमबत्ती लाई जाती हैं। तो पॉप की ध्वनि उत्पन्न होती हैं। इस टैस्ट को हाइड्रोजन की उपस्थिति दर्शाने के लिए प्रयोग करते हैं।
- क्षार + धातु → लवण + हाइड्रोजन
NaOH + Zn → Na2ZnO2 (सोडियम जिंकेट) + H2 - क्षारों के साथ सभी धातुएं इस प्रकार अभिक्रिया नहीं करतीं।
- अम्लों की धातु कार्बोनेट तथा धातु बाईकार्बोनेटों के साथ अभिक्रिया
धातु कार्बोनेट – अम्ल → लवण + कार्बन डाइआक्साइड + जल
Na2CO3(s) + 2HCl(l) → 2NaCl(aq) + H2O(l) + CO2(g)
धातु बाईकार्बोनेट + अम्ल → लवण + कार्बन डाइआक्साइड + जल
NaHCO3(s) + HCI(l) → NaCl(aq) + CO2(g) + H2O(g) - चूने के पानी का टैस्ट– उत्पादित कार्बन डाइआक्साइड को चूने के पानी से प्रवाहित करने पर
Ca(OH)2(aq) + CO2(g) → CaCO3(s)(सफ़ेद अवक्षेप) + H2O(l)
अधिक मात्रा में CO2 प्रवाहित करने पर निम्न अभिक्रिया होती हैं।
CaCO3(s) + H2O(l) + CO2(g) → Ca(HCO3)2aq - उदासीनीकरण अभिक्रिया
क्षार + अम्ल → लवण + जल
NaOH(aq) + HCI(aq) → NaCl(aq) + H2O(I)
जब अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है और परिणामस्वरूप लवण और जल प्राप्त होते हैं तो उदासीनीकरण अभिक्रिया होती हैं। - अम्लों के साथ धात्विक आक्साइड की अभिक्रियाएं धात्विक आक्साइड + अम्ल → लवण + जल
CuO + HCl → CuCl2 + H2O
नोट- कॉपर क्लोराइड के बनने के कारण विलयन का रंग नीला हो जाता है। - धात्विक आक्साइड को क्षारीय आक्साइड भी कहते हैं क्योंकि ये अम्ल के साथ क्रिया करके लवण और जल बनाते हैं।
- अधात्विक आक्साइड की क्षारों के साथ अभिक्रिया
अधात्विक आक्साइड + क्षार → लवण + जल
Ca(OH)2 +CO2 → CaCO3 + H2O
नोट- अधात्विक आक्साइड प्रवृत्ति में अम्लीय होते हैं क्योंकि ये क्षार के साथ अभिक्रिया करने पर लवण और जल बनाते हैं। - सभी अम्लीय विलयन विद्युतधारा प्रवाहित करते हैं।
- बल्ब का जलना इस बात को दर्शाता है कि अम्लीय विलयन में विद्युत धारा प्रवाहित होती हैं।
- जलीय विलयन में अम्ल और क्षारक
जल की उपस्थिति में अम्ल H’ions उत्पन्न करते हैं।
HCl + H2O → H3O+ + Cl–
H3O+ – हाइड्रोजन आयन
H+ + H2O → H3O+
– जल की उपस्थिति में क्षार आयन OH+ उत्पन्न करते हैं।
Mg(OH)2(g) Mg2+(aq) + 2OH–(aq) - क्षार– सभी क्षारक जल में घुलनशील नहीं होते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं। कुछ आम क्षार हैं-
NaOH – सोडियम हाइड्रोक्साइड
KOH – पोटैशियम हाइड्रोक्साइड
Ca(OH)2 – कैल्शियम हाइड्रोक्साइड
NH4OH – अमोनियम आइड्रोक्साइड - नोट- सभी क्षार क्षारक होते हैं परन्तु सभी क्षारक क्षार नहीं होते।
- जल के साथ अम्ल या क्षारक को मिलाते समय सावधानी बरतनी चाहिए। हमेशा अम्ल या क्षारक को ही जल में मिलाना चाहिए और लगातार इसे हिलाते रहना चाहिए, क्योंकि यह प्रक्रिया अत्यंत ऊष्माक्षेपी है।
- जब कोई अम्ल या क्षारक को जल में मिलाया जाता हैं तो ये तनुकृत जाते हैं। जल में मिलाने पर आयन की सांद्रता H3O + orOH में प्रति इकाई आयतन में कमी हो जाती है।
- क्षार तथा अम्ल की प्रबलता
किसी क्षार या अम्ल की प्रबलता उसके द्वारा उत्पन्न H+ आयन या OH आयनों की संख्या पर
निर्भर करती है।
किसी अम्ल या क्षारक की प्रबलता हम एक सार्वभौमिक सूचक द्वारा ज्ञात कर सकते हैं। इस सूचक को PH स्केल कहते हैं।
PH= पुसाांस एक जर्मन शब्द है जिसका अर्थ है शक्ति
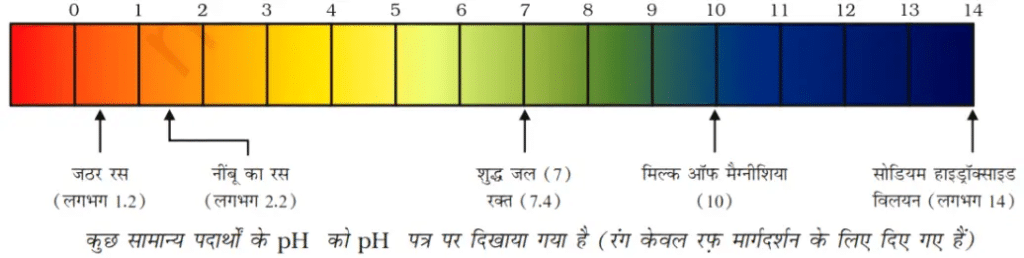
यह स्केल O (अति अम्लीय) से 14 अति क्षारीय तक pH ज्ञात करने के लिए उपयोग में लाया जाता है। - जल उदासीन है इसका pH7 है।
- pH पेपर- यह एक विशेष प्रकार का पेपर है जिसे pH ज्ञात करने के लिए उपयोग में लाया जाता है।
आप पढ़ रहे है : Class 10 Science Notes In Hindi Chapter – 2 अम्ल, क्षार
| pH की विभिन्नता | |||||
क्र. सं. | pH का मान | pH पेपर का रंग | विलयन की प्रकृति | H+ आयन सांद्रता | OH– आयन सांद्रता |
1. | 0 | गहरा लाल | अति अम्लीय | अत्यधिक | अति अल्प |
2. | 4 | संतरी या पीला | अम्लीय | अधिक | अल्प |
3. | 7 | हरा | उदासीन | बराबर | बराबर |
4. | 10 | नीला हरा या नीला | क्षारीय | अल्प | अधिक |
5. | 14 | गहरा नीला या जामुनी | अति क्षारीय | अति अल्प | अत्यधिक |
- प्रबल अम्ल अधिक मात्रा में H+ आयन उत्पन्न करते हैं।
उदाहरण- HCI, H2SO4 और HNO3. - दुर्बल अम्ल कम मात्रा में आयन उत्पन्न करते हैं।
उदाहरण CH3 COOH, H2CO3 (कार्बोनिक अम्ल) - प्रबल क्षार- प्रबल क्षार अधिक मात्रा में OH– आयन उत्पन्न करते हैं।
उदाहरण- सोडियम हाइड्रोक्साइड, पौटेशियम हाइड्रोक्साइड, कैल्शियम हाइड्रोक्साइड - दुर्बल क्षार– ये कम OH आयन उत्पन्न करते हैं।
उदाहरण- NH4OH
दैनिक जीवन में pH का महत्व
पाचन तंत्र में pH का महत्व
हमारे उदर में pH का स्तर हमारी कार्यशैली को नियंत्रित करता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिससे उदर में दर्द तथा जलन का अनुभव होता है। इस दर्द से मुक्त होने के लिए antacid जैसे क्षारकों का उपयोग किया जाता है। यह एन्टैसिड़ अम्ल की आधिक्य मात्रा को उदासीन करता है।
अम्लीय वर्षा का pH – वर्षा के जल में pH का मान 5.6 से कम होने पर यह अम्लीय वर्षा कहलाती हैं। जब अम्लीय वर्षा का जल नदियों में बहता हैं तो इसका pH मान भी कम हो जाता है। जिससे जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
बगीचे की मिट्टी का pH- अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है। यदि किसी स्थान की मिट्टी का pH कम या अधिक हो तो किसान उसमें आवश्यकतानुसार अम्लीय या क्षारीय उर्वरक मिलाते हैं।
हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास में जी जीवित रह सकते हैं।
दंत क्षय और pH – मुंह में उपस्थित बैक्टीरिया मुंह में उपस्थित शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। दंत मंजन के उपयोग से अम्ल की आधिक्य मात्रा को उदासीन किया जाता है जिसके परिणाम स्वरूप दंत क्षय को रोका जा सकता है।
लवण के संबंध में अधिक जानकारी
लवण परिवार
| क्रम. सं. | लवण का नाम | सूत्र | प्रयुक्त क्षार | प्रयुक्त अम्ल |
1. | पोटेशियम सल्फेट | K2SO4 | KOH | H2SO4 |
2. | सोडियम सल्फेट | Na2SO4 | NaOH | H2SO4 |
3. | सोडियम क्लोराइड | NaCl | NaOH | HCl |
4. | अमोनियम क्लोराइड | NH4Cl | NH4OH | HCl |
- नोट- सोडियम क्लोराइड तथा सोडियम सल्फेट सोडियम परिवार से संबंध रखते हैं क्योंकि उनमें एक समान प्रकार का मूलक है इसी प्रकार सोडियम क्लोराइड तथा पोटेशियम क्लोराइड भी क्लोराइड लवणों के परिवार से संबंध रखते हैं।
- उदासीन लवण
प्रबल अम्ल + प्रबल क्षार
pH मान = 7
उदाहरण- NaCl2, CaSO4 - अम्लीय लवण
प्रबल अम्ल + दुर्बल क्षार
pH का मान 7 से कम
उदाहरण- NH4CI, NH4NO3 - क्षारीय लवण
प्रबल क्षार + दुर्बल अम्ल
pH का मान 7 से अधिक
उदाहरण- CaCO3, CH3COONa
साधारण नमक – रसायनों का कच्चा पदार्थ
- सोडियम क्लोराइड NaCl को साधारण नमक कहा जाता है जिसे हम भोजन में इस्तेमाल करते हैं। इसे समुद्री जल से बनाया जाता है।
- रॉक Salt एक भूरे रंग की क्रिस्टल के रूप में पाया जाने वाला पदार्थ है। इसे कोयले की तरह निष्कर्षण करके प्राप्त किया जाता है।
- साधारण नमक हमारे दैनिक जीवन में काम आने वाले बहुत से रसायनों का महत्वपूर्ण कच्चा पदार्थ है।
उदाहरण- सोडियम हाइड्रोक्साइड, बेकिंग सोडा, वाशिंग सोडा तथा ब्लीचिंग पाउडर।
सोडियम हाइड्रोक्साइड
बनाने की विधि– सोडियम हाइड्रोक्साइड को बनाने के लिए क्लोर-क्षार प्रक्रिया का इस्तेमाल किया जाता है। इसे क्लोर-क्षार प्रक्रिया इसलिए कहते हैं क्योंकि इससे निर्मित पदार्थ क्लोरीन तथा क्षार हैं।
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + CI2(g) + H2(g)
| लवण NaCI | |||
| कैथोड पर हाइड्रोजन गैस | एनोड पर क्लोरीन गैस जय संयोधन, PVC, CFC’s तथा कीटनाशक बनाना | NaOH साबुन तथा डिटर्जेंट, कागज तथा फाइबर बनाना | |
| ईंधन तक उर्वरक में प्रयोग | |||
HCI | ब्लीच | ||
ब्लीचिंग पाउडर या विरजंक चूर्ण
बनाने की विधि– Ca(OH)2 + Cl2→ CaOCI2 + H2O
(कैल्शियम हाइड्रोक्साइड + क्लोरीन गैस → विरजंक चूर्ण + जल)
प्रयोग- सूत और सूती कपड़े का रंग उड़ाने में- फैक्ट्रियों तथा लांड्री में
- पेयजल को संक्रमण रहित करने में
बेकिंग सोडा या सोडियम हाइड्रोजन कार्बोनेट
बनाने की विधि–
����Sodium Chloride+�2�Water+��2Carbon dioxide+��3Ammonia→��4��+�����3Sodium Hydrogen Carbonate
सोडियम हाइड्रोजन कार्बोनेट को ऊष्मा देने पर 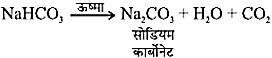
इस प्रक्रिया में उत्पादित CO2 केक, पेस्ट्री आदि को फुला देती है और उन्हें मुलायम बनाती है।
उपयोग
- घरेलू कार्यों में इस्तेमाल किया जाता हैं।
- बेकिंग पाउडर बनाने में प्रयोग क्योंकि जब बेकिंग सोडा को ऊष्मा मिलती हैं तो निम्न प्रक्रिया होती हैं।
NaHCO3 + H– → CO2 + H2O + Na2CO3 - एन्टासिड को बनाने में बेकिंग सोडा प्रयुक्त किया जाता हैं।
वाशिंग सोडा
बनाने की प्रक्रिया– सोडियम कार्बोनेट को जल में घोलकर क्रिस्टलीकृत किया जाता है। 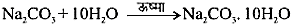
उपयोग:-
- काँच, साबुन और कागज के निर्माण में प्रयुक्त
- घरेलू कार्यों में सफाई के लिए
- कठोर जल को मृदु बनाने के लिए
- बोरेक्स के निर्माण के लिए।
क्रिस्टलन जल- लवण के एक इकाई सूत्र में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
कॉपर सल्फेट के क्रिस्टल को क्वथन नली में गर्म करने पर क्वथन नली में जल की बूंदें दिखाई पड़ती हैं।
जलीय कॉपर सल्फेट का रासायनिक सूत्र है- CuSO4, 5H2O
जिप्सम में भी क्रिस्टलन का जल पाया जाता है।
जिप्सम का रासायनिक सूत्र- CaSO4, 2H2O जब जिप्सम को 373 k पर गर्म किया जाता है तो यह CaSO4.½H2O (प्लास्टर और पेरिस) में बदल जाता है।
CaSO4,½H2O + 1½H2O → CasO4.2H2O
प्लास्टर और पेरिस का उपयोग– प्लास्टर और पेरिस का प्रयोग खिलौने बनाने में, सजावट का सामान बनाने में तथा सतह को समतल बनाने में किया जाता है।
प्लास्टर और पेरिस का प्रयोग डाक्टर टूटी हुई हड्डी को जोड़ने में करते हैं।
आएये अध्याय विस्तार में समझते है
Class 10 विज्ञान
अम्ल, क्षारक एवं लवण
अम्ल एवं क्षारक के रासायनिक गुणधर्म समझना
प्रयोगशाला में अम्ल एवं क्षारक
रंग में परिवर्तन के द्वारा यह सूचक हमें बताते हैं कि कोई पदार्थ अम्ल है या क्षारक। कुछ ऐसे पदार्थ होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में भिन्न हो जाती है। इन्हें गंधीय (Olfactory) सूचक कहते हैं।
अम्ल एवं क्षारक धातु के साथ कैसे अभिक्रिया करते हैं?
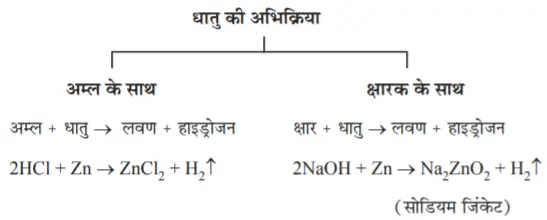
पॉप टैस्ट: हाइड्रोजन गैस से निहित परखनली के पास जब एक जलती हुई मोमबत्ती लाई जाती है, तो पॉप की ध्वनि उत्पन्न होती है। इस टैस्ट को हाइड्रोजन की उपस्थिति दर्शाने के लिए प्रयोग करते हैं।
धातु कार्बोनेट तथा धातु हाइड्रोजनकार्बोनेट अम्ल के साथ कैसे अभिक्रिया करते हैं?

CO2 की जांच टैस्ट: उत्पादित कार्बन डाइआक्साइड को चूने के पानी में प्रवाहित करने पर चूने का पानी दूधिया हो जाता है।
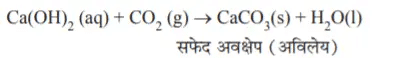
अधिक मात्रा में CO2 प्रवाहित करने पर:
CaCO3 (s) + H2 O(l) + CO2 (g) 
अम्ल एवं क्षारक परस्पर कैसे अभिक्रिया करते हैं?
अम्ल + क्षारक → लवण + जल
उदासीनीकरण अभिक्रिया: जब अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है और परिणामस्वरूप लवण और जल प्राप्त होते हैं तो उदासीनीकरण अभिक्रिया होती है।
उदाहरण: NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
प्रबल अम्ल + दुर्बल क्षारक → अम्लीय लवण + जल [विलयप का pH 7 से कम]
दुर्बल अम्ल + प्रबल क्षारक → क्षारीय लवण + जल [विलयन का pH 7 से अधिक]
प्रबल अम्ल + प्रबल क्षारक → उदासीन लवण + जल [विलयन का pH = 7]
दुर्बल अम्ल + दुर्बल क्षारक → उदासीन लवण + जल [विलयन का pH = 7]
अम्लों के साथ धात्विक ऑक्साइडों की अभिक्रियाएँ
धात्विक आक्साइड + अम्ल → लवण + जल
CaO + 2 HCl → CaCl2 + H2O
धात्विक आक्साइड की प्रवृति क्षारीय होती है क्योंकि ये अम्ल के साथ क्रिया करके लवण और जल बनाते हैं।
उदाहरण: CuO, MgO
क्षारक के साथ अधात्विक ऑक्साइड की अभिक्रियाएँ
अधात्विक ऑक्साइड + क्षारक → लवण + जल
CO2 + Ca(OH)2 → CaCO3 + H2O
अधात्विक ऑक्साइड प्रवृत्ति में अम्लीय होते हैं।


अम्लों एवं क्षारकों में समानताएँ
अम्ल की स्थिति में बल्ब जलने लगता है जैसा कि चित्र में दिखाया गया है। परंतु ग्लूकोज़ एवं ऐल्कोहॉल का विलयन विद्युत का चालन नहीं करते हैं। बल्ब के जलने से यह पता चलता है कि इस विलयन से विद्युत का प्रवाह हो रहा है। अम्लीय विलयन में विद्युत धारा का प्रवाह अम्ल में उपस्थित इन्हीं आयनों द्वारा होता है।
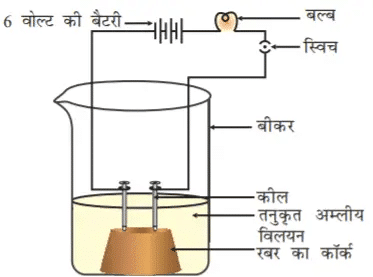
अम्लों में धनायन H+ तथा ऋणायन जैसे HCl में Cl–, HNO3 में NO3–, CH3COOH में CH3COO–, H2SO4 में SO42− होते हैं। चूँकि अम्ल में उपस्थित धनायन H+ है, इससे ज्ञात होता है कि अम्ल विलयन में हाइड्रोजन आयन H+(aq) उत्पन्न करता है, तथा इसी कारण उनका गुणधर्म अम्लीय होता है।
जलीय विलयन में अम्ल या क्षारक
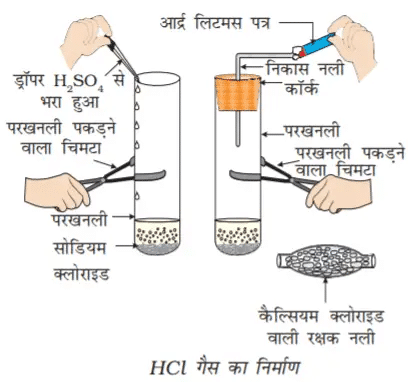
इस प्रयोग से यह स्पष्ट होता है कि जल की उपस्थिति में HCl में हाइड्रोजन आयन उत्पन्न होते हैं। जल की अनुपस्थिति में HCl अणुओं से H+ आयन पृथक नहीं हो सकते हैं।
HCl + H2O → H3O+ + Cl–
हाइड्रोजन आयन स्वतंत्र रूप में नहीं रह सकते लेकिन ये जल के अणुओं के साथ मिलकर रह सकते हैं। इसलिए हाइड्रोजन आयन को सदैव H+(aq) या हाइड्रोनियम आयन (H3O+) से दर्शाना चाहिए।
H+ + H2O → H3O+
अम्ल जल में H3O+ अथवा H+(aq) आयन प्रदान करता है। किसी क्षारक को जल में घोलने पर क्या होता है:
NaOH(s) →�2� Na+(aq) + OH–(aq)
क्षारक जल में हाइड्रॉक्साइड (OH–) आयन उत्पन्न करते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं।
अब तक हम जान चुके हैं कि सभी अम्ल H+(aq) तथा सभी क्षारक OH–(aq) उत्पन्न करते हैं, अतः अब हम उदासीनीकरण अभिक्रिया को निम्नलिखित रूप में व्यक्त कर सकते हैं।
अम्ल + क्षारक → लवण + जल
H(X + M) OH → MX + HOH
H+(aq) + OH–(aq) → H2O(l)
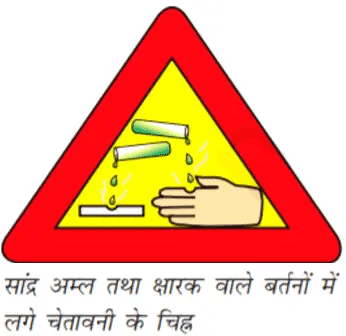
जल में अम्ल या क्षारक के घुलने की प्रक्रिया अत्यंत ऊष्माक्षेपी होती है। जल में सांद्र नाइट्रिक अम्ल या सल्फ़्यूरिक अम्ल को मिलाते समय अत्यंत सावधानी रखनी चाहिए।
अम्ल को सदैव धीरे-धीरे तथा जल को लगातार हिलाते हुए जल में मिलाना चाहिए। सांद्र अम्ल में जल मिलाने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फलित होकर बाहर आ सकता है तथा हम जल सकते हैं। साथ ही अत्यधिक स्थानीय ताप के कारण प्रयोग में उपयोग किया जा रहा काँच का पात्र भी टूट सकता है। सांद्र सल्फ़्यूरिक अम्ल के कैन (डिब्बा) तथा सोडियम हाइड्रॉक्साइड की बोतल पर चेतावनी के चिह्न (चित्र में प्रदर्शित) पर ध्यान दीजिए।
जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता (�3�+��−) में प्रति इकाई आयतन में कमी हो जाती है। इस प्रक्रिया को तनुकरण कहते हैं एवं अम्ल या क्षारक तनुकृत होते हैं।
अम्ल एवं क्षारक की प्रबलता
अम्ल-क्षारक के सूचकों का उपयोग करके अम्ल एवं क्षारक में अंतर प्रदर्शित किया जा सकता है।
सार्वत्रिक सूचक जो अनेक सूचकों का मिश्रण होता है, का उपयोग करके ज्ञात कर सकते हैं। सार्वत्रिक सूचक किसी विलयन में हाइड्रोजन आयन की विभिन्न सांद्रता को विभिन्न रंगों में प्रदर्शित करते हैं।
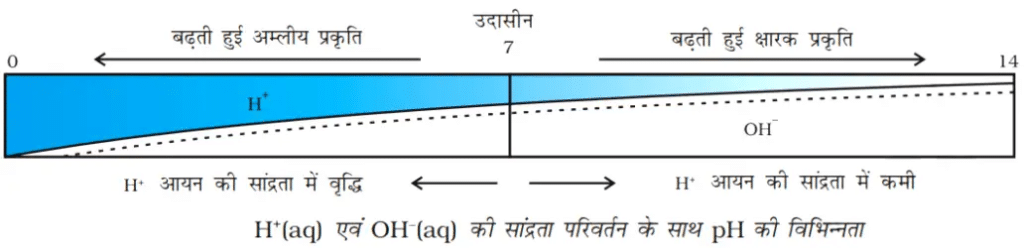
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया जिसे pH स्केल कहते हैं। इस pH में p सूचक है, ‘पुसांस’ (Potenz) जो एक जर्मन शब्द है, का अर्थ होता है ‘शक्ति’। इस pH स्केल से सामान्यत: शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। साधारण भाषा pH को एक ऐसी संख्या के रूप में देखना चाहिए जो किसी विलयन की अम्लता अथवा क्षारकीयता को दर्शाते हैं। हाइड्रोनियम आयन की सांद्रता जितनी अधिक होगी उसका pH उतना ही कम होगा।
किसी भी उदासीन विलयन के pH का मान 7 होगा। यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय विलयन होगा एवं यदि pH मान 7 से 14 तक बढ़ता है तो वह विलयन में OH– की सांद्रता में वृद्धि को दर्शाता है, अर्थात यहाँ क्षार की शक्ति बढ़ रही है (चित्र)। सामान्यत: pH सार्वत्रिक सूचक अंतर्भारित पेपर द्वारा ज्ञात किया जाता है।
दैनिक जीवन में pH का महत्त्व
अम्ल तथा क्षारक की शक्ति विलयन (जल) में क्रमश: H+ आयन तथा OH– आयन की संख्या पर निर्भर करती है। समान सांद्रता के हाइड्रोक्लोरिक अम्ल तथा ऐसीटिक अम्ल, जैसे एक मोलर, विलयन लेते हैं तो वह विभिन्न मात्रा में हाइड्रोजन आयन उत्पन्न करेंगे। अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं, जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलाएँगे।
क्या पौधे एवं पशु pH के प्रति संवेदनशील होते हैं?
हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) में ही जीवित रह सकते हैं। वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है। अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
बागीचे की मिट्टी का pH क्या है?
अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है।
हमारे पाचन तंत्र का pH
यह अत्यन्त रोचक है कि हमारा उदर हाइड्रोक्लोरिक अम्ल (Hydrochloric acid) उत्पन्न करता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है।
अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है। इस दर्द से मुक्त होने के लिए ऐन्टैसिड (antacid) जैसे क्षारकों का उपयोग किया जाता है। यह ऐन्टैसिड अम्ल की आधिक्य मात्रा को उदासीन करता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क ऑफ मैगनीशिया) जैसे दुर्बल क्षारक का उपयोग किया जाता है।
pH परिवर्तन के कारण दंत-क्षय
मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय प्रारंभ हो जाता है। दाँतों का इनैमल (दत्तवल्क) कैल्सियम हाइड्रोक्सीएपेटाइट ( कैल्सियम फॉस्फेट का क्रिस्टलीय रूप) से बना होता है जो कि शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता लेकिन मुँह की pH का मान 5.5 से कम होने पर यह संक्षारित हो जाता है।
मुँह में उपस्थित बैक्टीरिया, भोजन के पश्चात मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। भोजन के बाद मुँह साफ़ करने से इससे बचाव किया जा सकता है। मुँह की सफ़ाई के लिए क्षारकीय दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है जिसके परिणामस्वरूप दंत क्षय को रोका जा सकता है।
पशुओं एवं पौधों द्वारा उत्पन्न रसायनों से आत्मरक्षा
मधुमक्खी का डंक एक अम्ल छोड़ता है जिसके कारण दर्द एवं जलन का अनुभव होता है। डंक मारे गए अंग में बेकिंग सोडा जैसे दुर्बल क्षारक के उपयोग से आराम मिलता है। नेटल (nettle) के डंक वाले बाल मेथैनॉइक अम्ल छोड़ जाते हैं जिनके कारण जलन वाले दर्द का अनुभव होता है।
कुछ प्राकृतिक अम्ल
| प्राकृतिक स्रोत | अम्ल | प्राकृतिक स्रोत | अम्ल |
सिरका | ऐसीटिक अम्ल | खट्टा दूध (दही) | लैक्टिक अम्ल |
संतरा | सिट्रिक अम्ल | नींबू | सिट्रिक अम्ल |
इमली | टार्टरिक अम्ल | चींटी का डंक | मेथैनॉइक अम्ल |
टमाटर | ऑक्सैलिक अम्ल | नेटल का डंक | मेथैनॉइक अम्ल |
लवण के संबंध में अधिक जानकारी
लवणों का pH
प्रबल अम्ल एवं प्रबल क्षारक के लवण के pH का मान 7 होता है तथा ये उदासीन होते हैं। जबकि प्रबल अम्ल एवं दुर्बल क्षारक के लवण के pH का मान 7 से कम होता है तथा ये अम्लीय होते हैं। प्रबल क्षारक एवं दुर्बल अम्ल के लवण के pH का मान 7 से अधिक होता है तथा ये क्षारकीय होते हैं।
साधारण नमक से रसायन
हाइड्रोक्लोरिक अम्ल एवं सोडियम हाइड्रॉक्साइड के विलयन की अभिक्रिया से उत्पन्न लवण को सोडियम क्लोराइड कहते हैं। इसी लवण का हम अपने भोजन में उपयोग करते हैं।
समुद्री जल में कई प्रकार के लवण घुले होते हैं। इन लवणों से सोडियम क्लोराइड को पृथक किया जाता है। विश्व के कई भागों में भी ठोस लवण का निक्षेप होता है। बड़े आकार के यह क्रिस्टल प्राय: अपद्रव्यों के कारण भूरे रंग के होते हैं। इसे खनिज नमक कहते हैं। यह खनिज नमक तब बने जब युगों के व्यतीत होने के साथ समुद्र का कोई हिस्सा सूख गया। खनिज नमक का खनन भी कोयले की तरह होता है।
साधारण नमक-रसायनों का कच्चा पदार्थ
इस प्रकार प्राप्त साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों; जैसे-सोडियम हाइड्रॉक्साइड, बेकिंग सोडा, वाशिंग सोडा, विरंजक चूर्ण आदि के लिए एक महत्वपूर्ण कच्चा पदार्थ है।
सोडियम हाइड्रॉक्साइड
सोडियम क्लोराइड के जलीय विलयन (लवण जल) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर-क्षार प्रक्रिया कहते हैं क्योंकि इससे निर्मित उत्पाद – क्लोरीन (क्लोर) एवं सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
NaCl(aq) + 2H2O(l) → 2 NaOH(aq) + Cl2(g) + H2(g)
क्लोरीन गैस ऐनोड पर मुक्त होती है एवं हाइड्रोजन गैस कैथोड पर। कैथोड पर सोडियम हाइड्रॉक्साइड विलयन का निर्माण भी होता है। इस प्रक्रिया से उत्पन्न हुए तीनों उत्पाद उपयोगी हैं।
विरंजक चूर्ण
जलीय सोडियम क्लोराइड (लवण जल) के विद्युत अपघटन से क्लोरीन का निर्माण होता है। इस क्लोरीन गैस का उपयोग विरंजक चूर्ण के उत्पादन के लिए किया जाता है। शुष्क बुझा हुआ चूना [Ca(OH)2] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है। विरंजक चूर्ण को CaOCl2 से दर्शाया जाता है यद्यपि वास्तविक संगठन काफ़ी जटिल होता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंचक चूर्ण का उपयोग:
वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के लिए कागज़ की फैक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ़ कपड़ों के विरंजन के लिए
कई रासायनिक उद्योगों में एक उपचायक के रूप में, एवं
पीने वाले जल को जीवाणुओं से मुक्त करने के लिए।
बेकिंग सोडा
बेकिंग सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े आदि बनाने के लिए किया जाता है। कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है। इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) है। इसको बनाने में सोडियम क्लोराइड का उपयोग एक मूल पदार्थ के रूप में किया जाता है।
NaCl + H2O + CO2 + NH3 → NH4Cl (अमोनियम क्लोराइड) + NaHCO3 (सोडियम हाइड्रोजनकार्बोनेट)
यह एक दुर्बल असंक्षारक क्षारीय लवण है। खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती है:
2NaHCO3 (सोडियम हाइड्रोजनकार्बोनेट) 
बेकिंग सोडा का उपयोग
बेकिंग पाउडर बनाने में, जो बेकिंग सोडा (सोडियम हाइड्रोजनकार्बोनेट) एवं टार्टरिक अम्ल जैसा एक मंद खाद्य अम्ल का मिश्रण है।
इस अभिक्रिया से उत्पन्न कार्बन डाइऑक्साइड के द्वारा पावरोटी या केक में खमीर उठाया (फूल/उभर) जा सकता है तथा इससे ये मुलायम एवं स्पंजी हो जाता है।
सोडियम हाइड्रोजनकार्बोनेट भी ऐन्टैसिड का एक संघटक है। क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुँचाता है।
इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
धोने का सोडा
Na2CO3⋅10 H2O (धोने का सोडा) एक अन्य रसायन जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। आप ऊपर देख चुके हैं कि बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है। सोडियम कार्बोनेट के पुन: क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।
Na2CO3 (सोडियम कार्बोनेट) + 10H2O → Na2CO3⋅H2O
सोडियम कार्बोनेट एवं सोडियम हाइड्रोजनकार्बोनेट, कई औद्योगिक प्रक्रियाओं के लिए भी उपयोगी रसायन है।
धोने के सोडे के उपयोग
- सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज़ उद्योगों में होता है।
- इसका उपयोग बोरेक्स जैसे सोडियम यौगिक के उत्पादन में होता है।
- सोडियम कार्बोनेट का उपयोग घरों में साफ़-सफ़ाई के लिए होता है।
क्या लवण के क्रिस्टल वास्तव में शुष्क हैं?
शुष्क दिखने वाले कॉपर सल्फ़ेट क्रिस्टलों में क्रिस्टलन का जल होता है। जब क्रिस्टल को गर्म करते हैं तो यह जल हट जाता है एवं लवण का रंग श्वेत हो जाता है।
क्रिस्टल को पुन: जल से भिगोते हैं तो क्रिस्टल का नीला रंग वापस आ जाता है।
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं। कॉपर सल्फ़ेट के एक सूत्र इकाई में जल के पाँच अणु उपस्थित होते हैं। जलीय कॉपर सल्फ़ेट का रासायनिक सूत्र CuSO4⋅5H2O है। Na2CO3⋅10H2O का अणु आर्द्र है या नहीं।
जिप्सम एक अन्य लवण है जिसमें क्रिस्टलन का जल होता है। इसमें क्रिस्टलन के जल के दो अणु होते हैं। इसका रासायनिक सूत्र CaSO4⋅2H2O है। 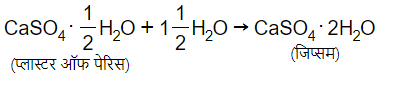
*******************
सारांश
- अम्ल-क्षारक सूचक रंजक या रंजकों के मिश्रण होते हैं जिनका उपयोग अम्ल एवं क्षारक की उपस्थिति को सूचित करने के लिए किया जाता है।
- विलयन में H+ (aq) आयन के निर्माण के कारण ही पदार्थ की प्रकृति अम्लीय होती है। विलयन में OH–(aq) आयन के निर्माण से पदार्थ की प्रकृति क्षारकीय होती है।
- जब कोई अम्ल किसी धातु के साथ अभिक्रिया करता है तो हाइड्रोजन गैस का उत्सर्जन होता है। साथ ही संगत लवण का निर्माण होता है।
- जब क्षारक किसी धातु से अभिक्रिया करता है तो हाइड्रोजन गैस के उत्सर्जन के साथ एक लवण का निर्माण होता है जिसका ऋण आयन एक धातु एवं ऑक्सीजन के परमाणुओं से संयुक्त रूप से निर्मित होता है।
- जब अम्ल किसी धातु कार्बोनेट या धातु हाइड्रोजनकार्बोनेट से अभिक्रिया करता है तो यह संगत लवण कार्बन डाइऑक्साइड गैस एवं जल उत्पन्न करता है।
- जल में अम्लीय एवं क्षारकीय विलयन विद्युत का चालन करते हैं क्योंकि ये क्रमशः हाइड्रोजन एवं हाइड्रॉक्साइड आयन का निर्माण करते हैं।
- अम्ल या क्षारक की प्रबलता की जाँच pH(0-14) स्केल के उपयोग से की जा सकती है जो विलयन में हाइड्रोजन आयन की सांद्रता की माप होता है।
- एक उदासीन विलयन के pH का मान 7 होता है जबकि अम्लीय विलयन के pH का मान 7 से कम एवं क्षारकीय विलयन के pH का मान 7 से अधिक होता है।
- सभी जीवों में उपापचय की क्रिया pH की एक इष्टतम सीमा में होती है।
- सांद्र अम्ल या क्षारक को जल के साथ मिश्रित करना एक अत्यन्त ऊष्माक्षेपी अभिक्रिया है। अम्ल एवं क्षारक एक-दूसरे को उदासीन करके लवण एवं जल का निर्माण करते हैं।
- लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
- हमारे दैनिक जीवन एवं उद्योगों में लवण के कई उपयोग हैं।
People Search in Google
Class 10 science Chapter 2 अम्ल क्षारक एवं लवण Notes in hindi
- अम्ल, क्षार एवं लवण : Science class 10th:Hindi Medium
Class 10 Science Notes In Hindi Chapter – 2 अम्ल, क्षार
Class 10 Science Chapter 2 अम्ल क्षार एवं लवण Notes In HIndi
Class 10 Chapter 2 Science Notes in Hindi अम्ल, क्षारक
Class 10 Science notes in hindi Chapter 2 अम्ल, क्षारक एवं लवण
[PDF] NCERT Class 10 Science Chapter 2: अम्ल, क्षारक एवं
अम्ल क्षारक एवं लवण कक्षा 10 || CLASS 10 SCIENCE …अम्ल क्षारक एवं लवण कक्षा 10 || CLASS 10 SCIENCE …
Chapter – 2nd Science (Acid, Bases And Salts ) अम्ल,क्षार एवं .
अम्ल, क्षारक एवं लवण कक्षा 10 नोट्स
रसायन विज्ञान कक्षा 10 अध्याय 2 नोट्स pdf
Class 10 Science Chapter 2 in Hindi PDF
अम्ल क्षार एवं लवण नोट्स PDF
अम्ल क्षार एवं लवण नोट्स PDF rbse
अम्ल क्षार एवं लवण नोट्स Class 10
कक्षा 10 विज्ञान अध्याय 2 नोट्स
अध्याय 2 अम्ल, क्षारक एवं लवण question answer
Class 10 Science Chapter 2 question answer
Class 10 Science Chapter 2 question answer PDF
Class 10 Science Chapter 2 PDF
Chapter 2 Science Class 10 Notes
acids, bases and salts class 10 questions and answers pdf
Class 10 Science Chapter 2 exercise Solutions
Class 10 Science Chapter 2 PDF Notes
Acids, Bases and Salts Class 10 Notes
RBSE Model paper Class 12 Political

बोर्ड परीक्षा की तैयारी को प्रबल व बेहतर बनाने के लिए हम लेकर आये है बोर्ड परीक्षा पाठ्यक्रम पर आधारित 10 मॉडल टेस्ट पेपर्स RBSE Model paper Class 12Political उपलब्ध है।
URL: https://my-notes.in/
Author: G S
4.89
Pros
- BEST NOTES