प्रिय विद्यार्थियों आप सभी का स्वागत है आज हम आपको Class 10 Science Notes PDF in Hindi Chapter 1 – Chemical Reactions and Equations in Hindi कक्षा 10 विज्ञान नोट्स हिंदी में उपलब्ध करा रहे हैं |Class 10 Vigyan Ke Notes PDF 2024
Table of Contents
10 Class Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण notes
यहां पर आपको क्लास 10 विज्ञान Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण के नोट्स नोट्स मिलेंगे जिसे आप पढ़ कर बोर्ड एग्जाम अच्छे नंबर आ सकते है .
chapter 1 raasaayanik abhikriyaaen evam samiikaraṇ
| Textbook | NCERT |
| Class | Class 10 |
| Subject | विज्ञान Science |
| Chapter | Chapter 1 |
| Chapter Name | रासायनिक अभिक्रियाएँ एवं समीकरण |
| Category | Class 10 Science Notes |
| Medium | Hindi |
अध्याय एक नजर में Class 10 Science Notes Chapter 1
- रासायनिक परिवर्तन- जब कभी कोई रासायनिक परिवर्तन होता है तो हम उसे रासायनिक अभिक्रिया कहते हैं।
उदाहरण- हमारे शरीर में भोजन का पाचन
- लोहे का जंग लगना
- रासायनिक समीकरण– रासायनिक अभिक्रिया को संकेतों के माध्यम से रासायनिक समीकरण द्वारा व्यक्त किया जाता है।
उदाहरण- मैग्नीशियम धातु का दहन करने पर मैग्नीशियम आक्साइड का उत्पादन होना
Mg + O2 → MgO - किसी भी रासायनिक अभिक्रिया को कुछ परिवर्तनों के आधार पर पहचाना जा सकता है जिनमें मुख्य अवस्था या रंग में परिवर्तन, गैस का उत्सर्जन या तापमान में परिवर्तन।
- रासायनिक अभिक्रियाओं को अधिक सूचनात्मक बनाने के लिए उनकी भौतिक स्थिति को दर्शाया जाता है जैसे गैस के लिए (g) द्रव लिए (l) ठोस के लिए (s) तथा जलीय विलयन के लिए (aq)।
- संतुलित रासायनिक समीकरण– अभिकारक तथा उत्पाद के प्रत्येक तत्व के परमाणुओं की संख्या को समान करने के लिए उसे संतुलित किया जाता है।
उदाहरण- Fe(s) + H2O(l) → Fe2O3(s) + H2(g) को इस प्रकार संतुलित किया जा सकता है। 3Fe(s) + 4H2O(g) → Fe2O3(s) + 4H2(g) - संयोजन अभिक्रिया- जिन अभिक्रियाओं में दो या दो से अधिक पदार्थ मिलकर एक पदार्थ बनाते हैं, उन्हें संयोजन अभिक्रिया कहते हैं।
उदाहरण- CaO + H2O → Ca(OH)
* {CaO – कैल्शियम आक्साइड (चूना पत्थर)}
* {H2O – जल}
Ca(OH) – कैल्शियम हाइड्रोक्साइड (बुझा हुआ चूना) - Ca(OH)2 को घरों में सफेदी के लिए प्रयुक्त किया जाता है। यह CO2 के साथ क्रिया करके CaCO3 बनाता है जिससे दीवारों पर चमक आती है।
Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O (l)
* {Ca(OH)2 – कैल्शियम हाइड्रोसाइड}
* {CaCO3 – कैल्शियम कार्बोनेट}
कोयले का दहन
C(s) + O2(g) → CO2(g)
जल का बनना
2H2(g) + O2(g) → 2H2O(I) - ऊष्माक्षेपी ऊष्मा उन्मोची अभिक्रियाएँ– वे अभिक्रियाएँ जिनमें अभिक्रिया के दौरान ऊष्मा निकलती हैं।
उदाहरण- CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)- श्वसन भी ऊष्माउन्मोची अभिक्रिया है।
- शाक सब्जियों का विघटन होकर कम्पोस्ट में बदलना।
- विघटन अभिक्रियाएँ- ऐसी अभिक्रियाएँ जिनमें एकल अभिकारक विघटित होकर दो या अधिक उत्पादों का निर्माण करता है। विघटन अभिक्रियाएँ तीन प्रकार की होती है।
वियोजन अभिक्रियाएँ- ऊष्मीय वियोजन- ऊष्मा के द्वारा की गई वियोजन अभिक्रिया
उदाहरण-
- विद्युतीय वियोजन- जलीय वियोजन मैं ऊर्जा विद्युत के रूप में प्रदान की जाती है।

- प्रकाशीय वियोजन- जब वियोजन के लिए प्रकाश के रूप में ऊर्जा प्रदान की जाती है।

सिल्वार ब्रोमाइड भी इसी प्रकार अभिक्रिया करता है।



- ऊष्मीय वियोजन- ऊष्मा के द्वारा की गई वियोजन अभिक्रिया
- ऊपरलिखिति दोनों अभिक्रियाओं का उपभोग श्वेत-श्याम फोटोग्राफी में किया जाता हैं।
- ऊष्माशोषी अभिक्रियाएँ- ऊष्मा अभिक्रियों में ऊष्मा का शोषण होता है।
2Ba(OH)2 + NH4Cl → 2BaCl2 + NH4OH
- ऊष्माशोषी अभिक्रियाएँ- ऊष्मा अभिक्रियों में ऊष्मा का शोषण होता है।
- विस्थापन अभिक्रियाएँ- ऐसे अभिक्रियाएं जिनमें एक तत्व दूसरे तत्व को उसके जलीय विलयन से विस्थापित करता है।
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
लोहे की कीलों का रंग भूरा हो जाता है और कापर सल्फेट का नीला रंग फीका हो जाता हैं।
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Pb(s) + CuCl2(sq) → PbCl2(aq) + Cu(s)
जिंक और सीसा धातु कापर की अपेक्षा अधिक अभिक्रियाशील है। ये कापर धातु को उसके यौगिक से विघटित कर देती है। - द्विविस्थापन अभिक्रियाएँ- ऐसी अभिक्रियाएँ जिनमें दो भिन्न यौगिक क्रिया करके दो नए यौगिक बनाते हैं।
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl(sq)
उपरोक्त अभिक्रिया के परिणामस्वरूप एक सफेद रंग का अवक्षेप बनता है। - अवक्षेपण अभिक्रिया- जिस अभिक्रिया में अवक्षेप का निर्माण होता हैं उसे अवक्षेपण अभिक्रिया कहते हैं।
Pb(NO3)2(aq) + 2KIaq → PbI2 ↓ + 2KNO3 - उपचयन– अभिक्रिया के दौरान जब किसी पदार्थ में आक्सीजन की वृद्धि या हाइड्रोजन का ह्रास होता है तो उसे उपचयन कहते हैं।

जब कॉपर को गर्म किया जाता है तो एक काला रंग आ जाता है। जब इस CuO से हाइड्रोजन गैस गुजारी जाती है तो यह दोबारा भूरे रंग का हो जाता है।
- अपचयन- ऐसी अभिक्रिया जिनमें आक्सीजन का ह्रास या हाइड्रोजन की वृद्धि होती हैं।
- रेडोक्स अभिक्रिया- ऐसी अभिक्रियाएँ जिनमें एक अभिकारक उपचयित होता हैं और दूसरा अपचयित होता है।

ZnO + C → Zn + CO
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 - संक्षारण– जब किसी धातु की सतह पर वायु, जल या किसी और पदार्थ की धुंधली परत चढ़ जाती है।
- लौहे पर जंग लगना
- चांदी पर काली परत चढ़ना
- विकृत गंधिता- वसायुक्त तथा तैलीय खाद्य सामग्री को लंबे समय तक रखने पर वे विकृत गंधित हो जाते हैं तथा उनका स्वाद व गंध बदल जाते हैं।
- खाद्य सामग्री को विकृत गंधिता से बचाने के लिए उनमें प्रति आक्सीकारक मिलाये जाते हैं।
अध्याय विस्तार में
रासायनिक समीकरण
जब ऑक्सीजन की उपस्थिति में मैग्नीशियम रिबन का दहन होता है तब यह मैग्नीशियम ऑक्साइड में परिवर्तित हो जाता है। वाक्य के रूप में किसी रासायनिक अभिक्रिया का विवरण बहुत लंबा हो जाता है। इसे संक्षिप्त रूप में भी लिखा जा सकता है। इसे शब्द-समीकरण के रूप में लिखना सबसे सरलतम विधि है। ऊपर दी गई अभिक्रिया का शब्द-समीकरण इस प्रकार होगा:

…(1)
अभिक्रिया (1) में मैग्नीशियम तथा ऑक्सीजन ऐसे पदार्थ हैं जिनमें रासायनिक परिवर्तन होता है, इन्हें अभिकारक कहते हैं। इस अभिक्रिया से एक नए पदार्थ मैग्नीशियम ऑक्साइड का निर्माण होता है, इसे उत्पाद कहते हैं।
शब्द-समीकरण में अभिकारकों के उत्पाद में परिवर्तन को उनके मध्य एक तीर का निशान लगाकर दर्शाया जाता है। अभिकारकों के बीच योग (+) का चिह्न लगाकर उन्हें बाईं ओर (LHS) लिखा जाता है। इसी प्रकार उत्पादों के बीच भी योग (+) का चिहन लगाकर उन्हें दाईं ओर (RHS) लिखा जाता है। तीर का सिरा उत्पाद की ओर होता है तथा यह अभिक्रिया होने की दिशा को दर्शाता है।
आप पढ़ रहे है : Class 10 Science Chapter 1 Notes in Hindi Medium
रासायनिक समीकरण लिखना
शब्दों की जगह रासायनिक सूत्र का उपयोग करके रासायनिक समीकरणों को अधिक संक्षिप्त तथा उपयोगी बनाया जा सकता है। रासायनिक समीकरण किसी रासायनिक अभिक्रिया को दर्शाता है। यदि हमने मैग्नीशियम, ऑक्सीजन तथा मैग्नीशियम ऑक्साइड के सूत्रों का स्मरण करें तो उपरोक्त शब्द-समीकरण इस प्रकार लिखा जा सकता है:
Mg + O2 ⟶ MgO …(2)
तीर के निशान के बाईं और दाईं ओर के तत्वों के परमाणुओं की संख्या की गिनती कर उनकी तुलना करें। क्या दोनों ओर तत्वों के परमाणुओं की संख्या समान है? यदि है, तो समीकरण संतुलित है। यदि नहीं, तो समीकरण असंतुलित है क्योंकि समीकरण के दोनों ओर का द्रव्यमान बराबर नहीं है। किसी अभिक्रिया का ऐसा रासायनिक समीकरण ढाँचा रासायनिक समीकरण कहलाता है। इस प्रकार समीकरण (2) मैग्नीशियम के वायु में जलने का ढाँचा समीकरण है।
संतुलित रासायनिक समीकरण का महत्व
किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है न ही विनाश। अर्थात किसी भी रासायनिक अभिक्रिया के उत्पाद तत्वों का कुल द्रव्यमान अभिकारक तत्वों के कुल द्रव्यमान के बराबर होता है।
दूसरे शब्दों में, रासायनिक अभिक्रिया के पहले एवं उसके पश्चात प्रत्येक तत्व के परमाणुओं की संख्या समान रहती है। इसलिए हमें कंकाली समीकरण को संतुलित करना आवश्यक है। हम रासायनिक समीकरण को चरणबद्ध संतुलित कैसे करना है देखेंगे।
क्रियाकलाप के शब्द-समीकरण को इस प्रकार दर्शाया जा सकता है:
जिंक + सल्फ़्यूरिक अम्ल ⟶ जिंक सल्फ़ेट + हाइड्रोजन
उपरोक्त शब्द-समीकरण को निम्नलिखित रासायनिक समीकरण से दर्शाया जा सकता है:
Zn + H2SO4 ⟶ ZnSO4 + H2 …(3)
समीकरण (3) में तीर के निशान के दोनों ओर के तत्वों के परमाणुओं की संख्या की तुलना करेंगे।
तत्व | अभिकारकों में परमाणुओं की संख्या (LHS) | उत्पाद में परमाणुओं की संख्या (RIS) |
Zn | 1 | 1 |
H | 2 | 2 |
S | 1 | 1 |
O | 4 | 4 |
समीकरण (3) में, तीर के निशान के दोनों ओर के प्रत्येक तत्व के परमाणुओं की संख्या समान है इसलिए यह एक संतुलित रासायनिक समीकरण है।
अब हम निम्न रासायनिक समीकरण को संतुलित करने का प्रयास करते हैं:
Fe + H2O ⟶ Fe3O4 + H2 …(4)
चरण 1: रासायनिक समीकरण को संतुलित करने के लिए सबसे पहले प्रत्येक सूत्र के चारों ओर एक बॉक्स बना लेंगे। समीकरण को संतुलित करते समय बॉक्स के अंदर कुछ भी परिवर्तन नहीं करेंगे।
Fe + H2O ⟶ Fe3O4 + H2 …(5)
चरण 2: असंतुलित समीकरण (5) में उपस्थित विभिन्न तत्वों के परमाणुओं की संख्या की सूची बना लेंगे।
तत्व | अभिकारकों में परमाणुओं की संख्या (LHS) | उत्पाद में परमाणुओं की संख्या (RIS) |
Fe | 1 | 3 |
H | 2 | 2 |
O | 1 | 4 |
चरण 3: सुविधा के लिए सबसे अधिक परमाणु वाले यौगिक को पहले संतुलित करेंगे चाहे वह अभिकारक हो या उत्पाद। उस यौगिक में सबसे अधिक परमाणु वाले तत्व को चुनेंगे। इस आधार पर हम Fe3O4 और उसके ऑक्सीजन तत्व को चुनते हैं। दाईं ओर ऑक्सीजन के चार परमाणु हैं जबकि बाईं ओर केवल एक।
ऑक्सीजन परमाणु को संतुलित करने के लिए:
ऑक्सीजन के परमाणु | अभिकारकों में | उत्पादों में |
(i) प्रारंभ में | 1 (H2O में) | 4(Fe3O4 में) |
(ii) संतुलित करने के लिए | 1 × 4 | 4 |
यह याद रखना आवश्यक है कि परमाणुओं की संख्या को बराबर करने के लिए हम अभिक्रिया में शामिल तत्वों तथा यौगिकों के सूत्रों को नहीं बदल सकते हैं। जैसे कि ऑक्सीजन परमाणु को संतुलित करने के लिए हम 4 गुणांक लगाकर 4H2O लिख सकते हैं लेकिन H2O4 या (H2O)4 नहीं। आंशिक रूप से संतुलित समीकरण अब इस प्रकार होगा:
Fe + 4H2O → Fe3O4 + H2 …(6)
(अंशिक रूप से संतुलित समीकरण)
चरण 4: Fe तथा H परमाणु अब भी संतुलित नहीं हैं। इनमें से किसी एक तत्व को चुनकर आगे बढ़ते हैं। अब हम आंशिक रूप से संतुलित समीकरण में हाइड्रोजन परमाणु को संतुलित करते हैं:
हाइड्रोजन परमाणु को बराबर करने के लिए दाईं ओर हाइड्रोजन अणु की संख्या को 4 कर देते हैं।
हाइड्रोजन के परमाणु | अभिकारकों में | उत्पादों में |
(i) प्रारंभ में | 8 (4H2O में) | 4(H2 में) |
(ii) संतुलित करने के लिए | 8 | 2 × 4 |
समीकरण अब इस प्रकार होगा:
Fe + 4H2O → Fe3O4 + 4H2 …(7)
(आंशिक रूप से संतुलित समीकरण)
चरण 5: ऊपर दिए समीकरण की जाँच करेंगे तथा तीसरा तत्व चुन लेंगे जो अब तक असंतुलित है। हम देखते है कि केवल लोहा ही एक तत्व है जिसे संतुलित करना शेष है।
लोहे (आयरन) के परमाणु | अभिकारकों में | उत्पादों में |
(i) प्रारंभ में | 1 (Fe में) | 3 (Fe3O4 में) |
(ii) संतुलित के लिए | 1 × 3 | 3 |
आप पढ़ रहे है : रासायनिक अभिक्रिया एवं समीकरण क्लास 10th Notes PDF
Fe को संतुलित करने के लिए बाईं ओर हम Fe के 3 परमाणु लेते हैं।
3Fe + 4H2O → Fe3O4 + 4H2 …(8)
चरण 6: अंत में, इस संतुलित समीकरण की जाँच के लिए हम समीकरण में दोनों ओर के तत्वों के परमाणुओं की संख्याओं का परिकलन करते हैं।
3Fe + 4H2O → Fe3O4 + 4H2 …(9)
(संतुलित समीकरण)
समीकरण में दोनों ओर के तत्वों के परमाणुओं की संख्या बराबर है। अतः यह समीकरण अब संतुलित है। रासायनिक समीकरणों को संतुलित करने की इस विधि को हिट एंड ट्रायल विधि कहते हैं क्योंकि सबसे छोटी पूर्णांक संख्या के गुणांक का उपयोग करके समीकरण को संतुलित करने का प्रयत्न करते हैं।
रासायनिक अभिक्रियाओं के प्रकार
रासायनिक क्रिया के समय किसी एक तत्व का परमाणु दूसरे तत्व के परमाणु में नहीं बदलता है। न तो कोई परमाणु मिश्रण से बाहर जाता है और न ही बाहर से मिश्रण में आता है। वास्तव में, किसी रासायनिक अभिक्रिया में परमाणुओं के आपसी आबंध के टूटने एवं जुड़ने से नए पदार्थों का निर्माण होता है।
संयोजन अभिक्रिया
कैल्सियम ऑक्साइड जल के साथ तीव्रता से अभिक्रिया करके बुझे हुए चूने (कैल्सियम हाइड्रोक्साइड) का निर्माण करके अधिक मात्रा में ऊष्मा उत्पन्न करता है।

…(1)
इस अभिक्रिया में कैल्सियम ऑक्साइड तथा जल मिलकर एकल उत्पाद, कैल्सियम हाइड्रोक्साइड बनाते हैं। ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं उसे संयोजन अभिक्रिया कहते हैं।
- कोयले का दहन
C(s) + O2(g) → CO2(g) …(2) - H2(g) तथा O2(g) से जल का निर्माण
2H2(g) + O2(g) → 2H2O(l) …(3)
दो या दो से अधिक पदार्थ (तत्व या यौगिक संयोग करके एकल उत्पाद का निर्माण करते हैं, ऐसी अभिक्रियाओं को संयोजन अभिक्रिया कहते हैं।
इससे अभिक्रिया मिश्रण गर्म हो जाता है। जिन अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है उन्हें ऊष्माक्षेपी रासायनिक अभिक्रिया कहते हैं। ऊष्माक्षेपी अभिक्रियाओं के कुछ अन्य उदाहरण हैं:
- प्राकृतिक गैस का दहन:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + ऊर्जा …(4) - हम सभी जानते हैं कि जीवित रहने के लिए हमें ऊर्जा की आवश्यकता होती है। यह ऊर्जा हमें भोजन से प्राप्त होती है। पाचन क्रिया के समय खाद्य पदार्थ छोटे-छोटे टुकड़ों में टूट जाते हैं। जैसे चावल, आलू तथा ब्रेड में कार्बोहाइड्रेट होता है। इन कार्बोहाइड्रेट के टूटने से ग्लूकोज़ प्राप्त होता है। यह ग्लूकोज़ हमारे शरीर की कोशिकाओं में उपस्थित ऑक्सीजन से मिलकर हमें ऊर्जा प्रदान करता है। इस अभिक्रिया का विशेष नाम श्वसन है जिसका अध्ययन हम अध्याय 6 में करेंगे।

- शाक-सब्जियों (वनस्पति द्रव्य) का विघटित होकर कंपोस्ट बनना भी ऊष्माक्षेपी अभिक्रिया का ही उदाहरण है।
वियोजन (अपघटन) अभिक्रिया
सल्फ़र के दहन से उत्पन्न उस अभिलाक्षणिक (विशिष्ट) गंध को भी आप सूँघ सकते हैं। 
अभिक्रिया में एकल अभिकर्मक टूट कर छोटे-छोटे उत्पाद प्रदान करता है। यह एक वियोजन अभिक्रिया है। गर्म करने पर फ़ेरस सल्फ़ेट (FeSO4⋅7H2O) का क्रिस्टल जल त्याग देता है और क्रिस्टल का रंग बदल जाता है। इसके उपरांत यह फ़ेरिक ऑक्साइड (Fe2O3), सल्फ़र डाइऑक्साइड (SO2) तथा सल्फ़र ट्राइऑक्साइड (SO3) में वियोजित हो जाता है। फ़ेरिक ऑक्साइड ठोस है जबकि SO2 तथा SO3 गैसें हैं।
आप पढ़ रहे है : क्लास 10th साइंस चैप्टर 1 नोट्स
ऊष्मा देने पर कैल्सियम कार्बोनेट का कैल्सियम ऑक्साइड तथा कार्बन डाइऑक्साइड में वियोजित होना एक प्रमुख वियोजन अभिक्रिया है जिसका उपयोग विभिन्न उद्योगों में होता है। कैल्सियम ऑक्साइड को चूना या बिना बुझा हुआ चूना कहते हैं। इसके अनेक उपयोगों में से एक उपयोग सीमेंट के निर्माण में होता है। ऊष्मा के द्वारा की गई वियोजन अभिक्रिया को ऊष्मीय वियोजन कहते हैं।

आप पढ़ रहे है : अध्याय 1 रासायनिक अभिक्रिया एवं समीकरण
भूरे रंग का धुआँ उत्सर्जित होता है। यह नाइट्रोजन डाइऑक्साइड (NO2) का धुआँ है। यह अभिक्रिया इस प्रकार होती है:

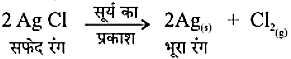
सूर्य के प्रकाश में श्वेत रंग का सिल्वर क्लोराइड धूसर रंग का हो जाता है। प्रकाश की उपस्थिति में सिल्वर क्लोराइड का सिल्वर तथा क्लोरीन में वियोजन के कारण से ऐसा होता है।
2AgCl(s) 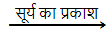
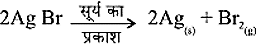
सिल्वर ब्रोमाइड भी इसी प्रकार अभिक्रिया करता है।
2AgBr(s) 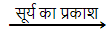
अभिक्रिया का उपयोग श्याम-श्वेत फ़ोटोग्राफी में किया जाता है।
वियोजन अभिक्रिया में अभिकारकों को तोड़ने के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है। जिन अभिक्रियाओं में ऊर्जा अवशोषित होती है उन्हें ऊष्माशोषी अभिक्रिया कहते हैं।
विस्थापन अभिक्रिया
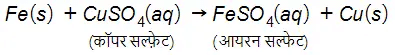
…(11)
इस अभिक्रिया में लोहे (आयरन) ने दूसरे तत्व कॉपर को कॉपर सल्फ़ेट के विलयन से विस्थापित कर दिया या हटा दिया। इस अभिक्रिया को विस्थापन अभिक्रिया कहते हैं। विस्थापन अभिक्रिया के कुछ अन्य उदाहरण:
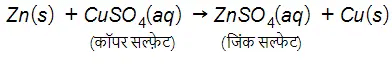
…(12)
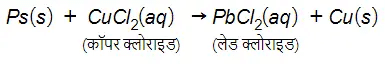
…(13)
जिंक तथा लेड, कॉपर की अपेक्षा अधिक क्रियाशील तत्व हैं। वे कॉपर को उसके यौगिक से विस्थापित कर देते हैं।
द्विविस्थापन अभिक्रिया
श्वेत रंग के एक पदार्थ का निर्माण होता है जो जल में अविलेय है। इस अविलेय पदार्थ को अवक्षेप कहते हैं। जिस अभिक्रिया में अवक्षेप का निर्माण होता है उसे अवक्षेपण अभिक्रिया कहते हैं।
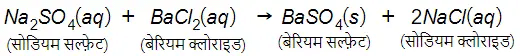
…(14)
Ba2+ तथा SO42− की अभिक्रिया से BaSO4 के अवक्षेप का निर्माण होता है। एक अन्य उत्पाद सोडियम कलोराइड का भी निर्माण होता है जो विलयन में ही रहता है। वे अभिक्रियाएँ जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।
उपचयन एवं अपचयन
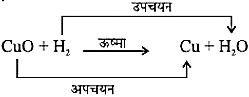
कॉपर चूर्ण की सतह पर कॉपर ऑक्साइड (II) की काली परत चढ़ जाती है। यह कॉपर ऑक्साइड कॉपर में ऑक्सीजन के योग से बना है।
2Cu + O2 
यदि इस गर्म पदार्थ (CuO) के ऊपर हाइड्रोजन गैस प्रवाहित की जाए तो सतह की काली परत भूरे रंग की हो जाती है क्योंकि इस स्थिति में विपरीत अभिक्रिया संपन्न होती है तथा कॉपर प्राप्त होता है।
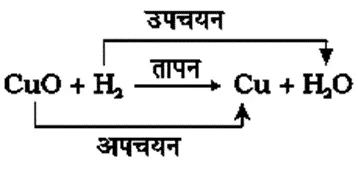
CuO + H2 
अभिक्रिया के समय जब किसी पदार्थ में ऑक्सीजन की वृद्धि होती है तो कहते हैं कि उसका उपचयन हुआ है। तथा जब अभिक्रिया में किसी पदार्थ में ऑक्सीजन का ह्रास होता है तो कहते हैं कि उसका अपचयन हुआ है।
अभिक्रिया (16) में कॉपर (II) ऑक्साइड में ऑक्सीजन का ह्रास हो रहा है इसलिए यह अपचयित हुआ है। हाइड्रोजन में ऑक्सीजन की वृद्धि हो रही है इसलिए यह उपचयित हुआ है। अर्थात, किसी अभिक्रिया में एक अभिकारक उपचयित तथा दूसरा अभिकारक अपचयित होता है। इन अभिक्रियाओं को उपचयन-अपचयन अथवा रेडॉक्स अभिक्रियाएँ कहते हैं।
…(17)
रेडॉक्स अभिक्रिया के कुछ अन्य उदाहरण है:
ZnO + C → Zn + CO …(18)
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 …(19)
अभिक्रिया (18) में कार्बन उपचयित होकर CO तथा ZnO अपचयित होकर Zn बनता है।
अभिक्रिया (19) में HCl, Cl2 में उपचयित तथा MnO2, MnCl2 में अपचयित हुआ है।
ऊपर के उदाहरणों के आधार पर हम कह सकते हैं कि यदि किसी अभिक्रिया में पदार्थ का उपचयन तब होता है जब उसमें ऑक्सीजन की वृद्धि या हाइड्रोजन का ह्रास होता है। पदार्थ का अपचयन तब होता है जब उसमें ऑक्सीजन का ह्रास या हाइड्रोजन की वृद्धि होती है।


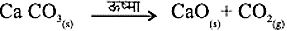
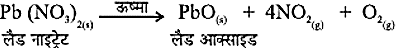

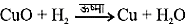
Science 10th class hindi medium notes download nhi ho rahe h apka telegram join kiya h lekin usme only chapter 2 and 3 h …please complete chapters provide karaye
telegram channel par mil jayege ji